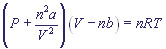 , где
, где
УРАВНЕНИЕ СОСТОЯНИЯ РЕАЛЬНОГО ГАЗА
Уравнение состояния реальных (неидеальных) газов называется уравнением Ван-дер Ваальса. Реальные газы редко подчиняются закону для идеального газа. Максимальные отклонения от идеального поведения наблюдаются при высоких давлениях и при низких температурах. При этих условиях объем системы становится относительно малым и собственный объем молекул уже составляет заметную часть общего объема. Кроме того, молекулы находятся на близких расстояниях друг от друга, что приводит к возникновению межмолекулярных взаимодействий. Ван-дер-Ваальс предложил включить в уравнение состояния реального газа два дополнительных члена: константу a, чтобы скомпенсировать уменьшение давления из-за межмолекулярного притяжения, и константу b, представляющую собой эффективный объем молекул газа:
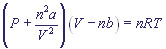 , где
, где
p - давление газа,
V - объем, занимаемый данным количеством молей газа,
n - количество молей,
R - универсальная газовая постоянная,
T - абсолютная температура,
a, b - константы Ван-дер-Ваальса, подбираемые для разных газов эмпирически по величинам отклонений от идеального поведения. Они бывают рассчитаны на 1 моль газа, их численные значения можно найти в специальных таблицах.