Модель переноса электрона пластоцианином в люмене с одной стороны, учитывает сложную геометрию люминального пространства, а с другой стороны достаточно подробно описывает электростатические взаимодействия белков – участников электронного транспорта.
Пластоцианин – небольшой водорастворимый белок, основная функция которого заключается в переносе электронов от цитохромного bf комплекса к фотосистеме 1. Пластоцианин диффундирует в замкнутом внутреннем объеме (люмене) тилакоидов хлоропластов зеленых растений (рис. 1).
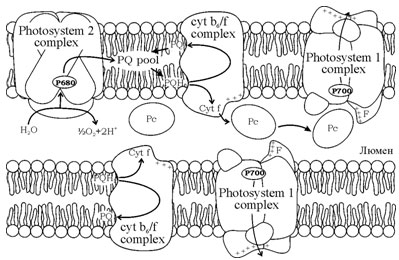
Рис. 1. Схема фотосинтетического электронного транспорта. Показаны две тилакоидные мембраны и люменальное пространство между ними. В мембраны встроены мультиферментные комплексы фотосистема 1, фотосистема 2, цитохромный b6/f комплекс. В люминальном пространстве диффундирует подвижный переносчик – белок пластоцианин (Рс). Стрелками изображен транспорт электронов.
Молекулы пластоцианина окисляют цитохром f и восстанавливают реакционный центр фотосистемы 1, диффундируя в люминальном пространстве на довольно большие расстояния (сотни нм), перенося электроны между гранальными и стромальными областями в тилакоидах. В нативном хлоропласте толщина люмена (40-100 Å) сравнима с размерами пластоцианина (40х28х30 Å). Поэтому в люмене диффузия пластоцианина сильно затруднена выступающими частями трансмембранных мультиферментных комплексов и скорость диффузии и электронного транспорта зависит от ширины люмена, расстояния диффузии и структуры люминального пространства.
Известно, что электростатические взаимодействия играют ключевую роль при связывании пластоцианина с мультиферментными комплексами: благодаря наличию электростатических сил притяжения и отталкивания диффузия пластоцианина к сайту связывания с белковым комплексом имеет направленный характер, а молекула пластоцианина ориентируется в электрическом поле комплекса.
Для передачи электрона от цитохрома f на пластоцианин необходимо, чтобы пластоцианин подошел близко к цитохрому f и образовался комплекс Pc-Cyt f. Физическими механизмами, благодаря которым происходит перемещение и образование комплексов, являются диффузия и электростатические взаимодействия. Сам процесс формирования комплекса белков может быть условно разделен на несколько этапов: (1) броуновскую диффузию белков к месту докинга; (2) их сближение за счет действия электростатических сил притяжения между молекулами, взаимную ориентацию молекул в пространстве и формирование предварительного комплекса; (3) образование финального комплекса и перенос электрона в нем.
В качестве редокс центра в пластоцианине выступает атом меди, он связан с четырьмя лигандами – His37, Cys84, His87 и Met92 (рис. 2). Несмотря на то, что атом меди закрыт от молекул растворителя, лиганд His87 выступает на поверхность белка и окружен гидрофобными остатками. Этот гидрофобный участок считают основным сайтом связывания с PSI и cyt f. На поверхности пластоцианина находится два отрицательно заряженных патча. Один из патчей расположен около Tyr83, рядом с лигандом Cys84, и образован Asp42, Glu43, Asp44 и Asp51, второй патч находится на противоположном участке молекулы и образован Glu59, Glu60, Asp61, and Glu68.
Сейчас известны структуры пластоцианинов из многих организмов (тополь, петрушка, шпинат и др.) в окисленном и восстановленном состояниях (на атоме Cu заряд +2e и +1e, соответственно) и при разных рН.
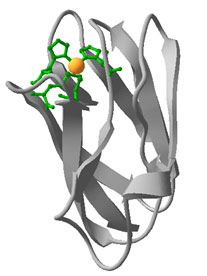
Рис. 2. Структура молекулы пластоцианина из Spinacia Oleracea (в Protein Data Bank структура 1AG6). Рисунок получен с помощью программы Swiss-PdbViewer. На рисунке зеленым цветом обозначены аминокислоты, которые являются лигандами к атому Cu (показан в виде желтой сферы).
Цитохром f – самая крупная субъединица цитохромного b6f комплекса, является терминальным акцептором цитохромного b6f комплекса и передает электроны на пластоцианин. Единственная ?-спираль цитохрома f пронизывает мембрану и держит белок заякоренным, однако большая часть белка находится в люмене. Люминальная часть cyt f состоит из двух доменов. Большой домен расположен ближе к мембране и состоит из антипараллельного β-сэндвича, образованного двумя ?-листами, и небольшого гем-связывающего пептида. Малый домен имеет смешанную укладку бочонок-сэндвич и встроен между двумя ?-тяжами большого домена. На большем домене между двумя короткими спиралями на N-конце белка находится гем. Гем ковалентно связан с двумя консервативными аминокислотными остатками из второй спирали – Cys21 и Cys24. Пятый лиганд атома железа в геме – His25, шестой – α-аминогруппа N-терминального аминокислотного остатка тирозина 1.
В настоящее время известны структуры люминальной части cyt f из турнепса (PDB структуры 1CTM, 1HCZ), зеленой водоросли Chlamydomonas reinhardtii (PDB структуры 1CFM, 1EWH) и цианобактерии Phormidium Laminosum (PDB структура 1CI3).
Цитохром f из турнепса, несмотря на суммарный отрицательный заряд, имеет обширную область положительного электростатического потенциала, сформированную положительно заряженными аминокислотными остатками большого (Lys58, Lys65, Lys66) и малого (Lys185, Lys187, Arg209) доменов. Исследование ЯМР структуры комплекса, образованного пластоцианином из шпината и цитохрома f из турнепса (PDB структура 2PCF), показало, что данные остатки расположены в комплексе рядом с отрицательно заряженными остатками пластоцианина – Asp 42, 43, 44 и Glu 59, 60.
Для регистрации изменения концентрации окисленных и восстановленных форм cyt f и Pc при их реакции в растворе используют методы быстрого смешения Rapid Mix, остановки потока stopped-flow.
Кривые восстановления Pc (или окисления cyt f) являются однофазными. С помощью метода ЯМР спектроскопии определены константы скорости второго порядка для различных мутантов пластоцианина в зависимости от ионной силы и рН раствора. С увеличением ионной силы константа скорости падает, это говорит о том, что в связывании Pc и cyt f определяющую роль играет электростатическое притяжение между молекулами.
Простейшая кинетическая схема реакций Pc и cyt f выглядит следующим образом:
где kon – константа связывания белков, ket – константа скорости транспорта электрона в комплексе, PcI – восстановленный Pc (с Cu+), PcII – окисленный Pc (с Cu2+), cyt fred – восстановленный cyt f, cyt fox – окисленный cyt f.
Согласно (Kaant, Young et al. 1996) при ионной силе 100 мМ минимальное значение для константы скорости транспорта электрона ket с cyt f на Pc – 26*103с–1, константа связывания kon – 18*107 (М*с)–1, согласно (Modi, He et al. 1991) для реакции cyt f из семян капусты и Pc из гороха ket равна 62*103с–1, а kon равна 4.35*10–1 (М*с)–1. Различия в константах связаны с разными видами cyt f.
ПАРАМЕТРЫ МОДЕЛИ
В прямой модели молекулы белков совершают хаотическое броуновское движение. В результате броуновского движения может происходить сближение двух или большего количества белков на расстояние электростатического взаимодействия. При этом белки ориентируются в суммарном электрическом поле других белков и могут занять выгодную позицию для связывания (докинга). Занятие белком выгодной для докинга позиции означает, что расстояния между взаимодействующими частями молекул должно быть меньше некоторых расстояний (параметров модели), которые мы называем расстояниями докинга. Правильный подбор параметров модели (расстояний докинга) обеспечивает выгодную для последующего связывания взаимную ориентацию белков относительно друг друга. Таким образом, расстояниями докинга r мы называем расстояния между определенными атомами молекул пластоцианина и цитохрома f в комплексе. Связывание белков, занимающих выгодную взаимную ориентацию, происходит с некоторой вероятностью p, которую мы называем вероятностью докинга.
После связывания восстановленная молекула цитохрома f передает электрон на находящуюся с ней в комплексе молекулу пластоцианина за некоторое время. При этом происходит изменение редокс-состояния молекул. Время передачи электрона в комплексе, вероятность связывания белков (докинга) и расстояния докинга являются параметрами прямой модели.
Модельные расстояния докинга и экспериментальные данные о строении комплекса пластоцианина и цитохрома f представлены в таблице 1.
Таблица 1. Расстояния между атомами в комплексе Pc-cyt f, определенные методом ЯМР в работе (Ubbink, Ejdebeck et al. 1998), и расстояния, используемые нами в модели в качестве условия образования комплекса.
| Аминокислотные остатки Pc и cyt f, расположенные рядом в комплексе Pc-cyt f |
Номера и названия атомов, между которыми измеряется расстояние |
R, Å
Расстояние в комплексе (Ubbink, Ejdebeck et al. 1998) |
R, Å
Расстояние в модели |
| Pc |
cyt f |
| Asp42-Arg209 | 591 – OD2 | 3278 – HH2 | 4.1 | 18 |
| Glu43-Lys187 | 607 – HB | 2930 – HE | 1.34 | 18 |
| Asp44-Lys185 | 618 – OD2 | 2895 – HZ | 3.56 | 18 |
| Glu60-Lys58 | 842 – HA | 912 – HZ | 4.35 | 25 |
| – | 1435 – Cu | 3881 – Fe | 10.7–11.3 | 40 |
Последующие процессы образования финального комплекса учтены в модели неявно с помощью параметра вероятности связывания белков: связывание двух белков, расстояния между которыми удовлетворяют условиям связывания, происходит с некоторой вероятностью p. Она проверяется на каждом шаге модели: генерируется случайное число от 0 до 1, если оно меньше p, то считается, что комплекс образовался, если больше – то нет. Если комплекс не образовался, то белки могут разойтись или остаться, и на следующем шаге им опять предоставляется возможность образовать комплекс с вероятностью p.
После связывания белков может происходить передача электрона внутри комплекса с восстановленной молекулы белка на окисленную за некоторое время. При этом происходит изменение редокс-состояния молекул.
Модель позволяет изучать влияние ионной силы и распределения зарядов на молекулах, рН, температуры на кинетические характеристики взаимодействия белков.
Модельными параметрами, значения которых нужно подбирать для совпадения результатов моделирования с экспериментом, являются вероятность связывания белков и расстояния связывания. Другие же параметры модели – шаг по времени и шаг сетки для расчета потенциала – оцениваются, исходя из физических принципов, и в дальнейшем не меняются.