ОБЗОРЫ
Елькин Ю.Е. "Генные сети"
Генными сетями (ГС) принято называть [1] группу координировано экспрессирующихся
генов, контролирующих выполнение определенной функции организма. ГС содержит [1]
- ядро - группу координированно экспрессирующихся генов,
- кодируемые ими белки,
- пути передачи сигналов от мембраны к ядру, обеспечивающие активацию или подавление
транскрипции в ответ на внешние стимулы,
- обратные связи (ОС),
- низкомолекулярные соединения, осуществляющие переключение функций ГС, гормоны,
метаболиты, энергетические компоненты.
Регуляция функций ГС происходит на уровне транскрипции, трансляции, сплайсинга,
деградации белков, активного мембранного транспорта и т.д.
Исследование ГС особенно актуально в так называемую постгеномную эпоху, основной
задачей которой является интерпретация информации, полученной при расшифровке
геномов, выяснение механизмов функционирования генов. Для этого необходимо исследовать
не только отдельные гены, но и их взаимодействие, вместе с необходимыми белками.
Моделью такой взаимодействующей группы генов и белков как раз и является генная
сеть. Концепция ГС позволяет учесть иерархию строения организма: локальные ГС
более низкого уровня, решая свои частные задачи, объединяются в сети более высокого
уровня. ГС обмениваются друг с другом сигналами.
Исследование ГС может помочь в решении следующих задач:
- Понимание механизмов работы организма
- Моделирование различных систем и организма в целом
- Способ дешевой проверки воздействия веществ (лекарств) и других факторов на
биосистему
- Изучение влияния мутаций на ГС. Распознавание типа мутации по поведению ГС.
- Конструирование искусственных ГС (трансгенные технологии)
В целом, концепция ГС соответствует тенденции целостного описания организма in
silico , попытки которого стали особенно популярны в последнее время, например,
в рамках проекта "Physiome" (см., например, [47])
Первые теоретические работы, посвященные анализу организации молекулярно-генетических
систем управления у прокариот появились еще в 1960-х годах [2].
В связи с генными сетями возникают три основных задачи:
- построение генной сети;
- удобное для использования хранение информации о ГС вместе с методами визуализации
ее структуры;
- анализ ее работы (т.е. структуры и динамики).
Необходимые сведения о работе клетки
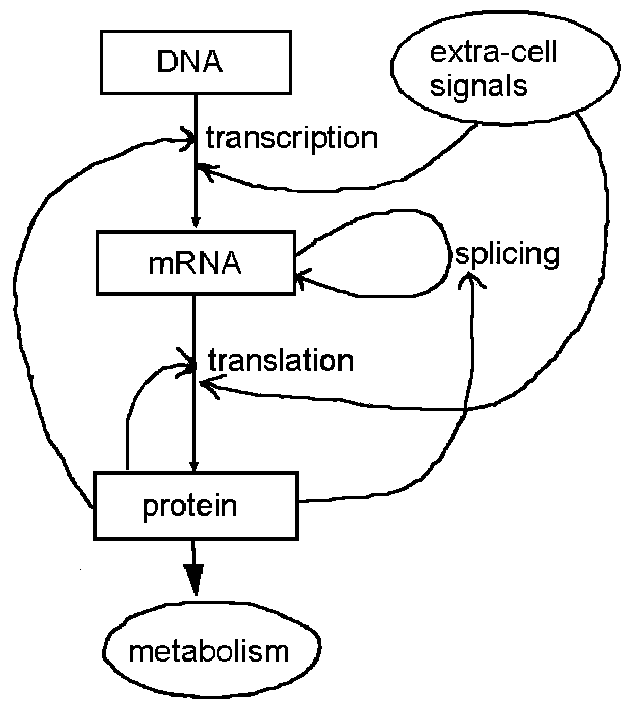
Основные процессы (сплошные стрелки) при синтезе белка в клетке и регуляторные
воздействия (пунктирные стрелки) упрощенно показаны на рисунке 1. В регуляции
участвуют и другие компоненты клетки, например, микро-РНК [3] способны образовывать
комплексы с мРНК, подавляя процесс трансляции или разрушая саму мРНК.
При сплайсинге из мРНК удаляются интроны, т.е. фрагменты, не имеющие соответствия
в белковой цепи, полученной затем при трансляции. В противоположность им участки,
ДНК или мРНК, отображаемые в последствии при помощи генетического кода на участки
транслируемого белка называются экзонами.
Регулирование транскрипции осуществляется при воздействии
на специальные регуляторные участки ДНК, что приводит к инициализации, подавлению
или изменению скорости процесса транскрипции. Поэтому одним из важных вопросов
при построении ГС является нахождение таких регуляторных участков ДНК и изучение
механизма их взаимодействия с регуляторами.
Работа ГС тесно связана с метаболическими процессами в клетке. С одной стороны,
по отношению к ним ГС выступают в качестве регулятора. С другой стороны, метаболические
процессы являются фоном для работы ГС и сильно влияют на ее режимы. Однако, при
изучении ГС более важно понимание динамики процессов, чем при изучении метаболизма.
Построение ГС
Для построения ГС необходимо обнаружить ее элементы и установить характер связей
между ними. Это означает, что необходимо выявить гены, участвующие в формировании
сети, их регуляторные элементы (промотеры и др.), синтезируемые ими белки, пути
передачи сигналов в клетке. Кроме того необходимо задать уравнения, характеризующие
динамику ГС и параметры этих уравнений. Привлечение этой информации идет тремя
путями:
- Накопление в БД уже имеющихся в литературе сведений и их использование при построении
новых ГС. Для этой цели в GeneNet имеется возможность вводить информацию об отдельных
процессах в клетке. Впоследствии такие процессы можно объединять в ГС.
- Получение необходимой информации в ходе натурных экспериментов.
- Получение необходимой информации из математического анализа структуры биополимеров,
прежде всего ДНК и РНК. Сюда относятся выяление интронов и экзонов, промотеров.
Некоторые сведения на эту тему можно найти в [1].
Таким образом, задача построения ГС фактически интегрирует в себя весь комплекс
задач молекулярной биологии и биоинформатики.
Основным методом получения информации о том что чью экспрессию и как регулирует
является метод обратного инжиниринга (reversed engineering). В этом подходе наблюдается
последовательность временных паттернов экспрессии и пытаются построить набор законов,
который мог бы порождать такую последовательность паттернов. Однако в [20] высказаны
и некоторые сомнения в эффективности данного метода. Для дискретной ГС в [21]
получено, что число необходимых измерений будет порядка 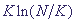 , где N - число генов в
сети, K - среднее число регуляторных связей на один ген. Способ определения параметров
динамики ГС методом обратного инжиниринга для случая линейных уравнений описан
в [13] , где N - число генов в
сети, K - среднее число регуляторных связей на один ген. Способ определения параметров
динамики ГС методом обратного инжиниринга для случая линейных уравнений описан
в [13]
Один из подходов к распознаванию промотерных участков ДНК предложен в [16]. Подход
состоит в вычислении некоторой функции (нуклеосомный потенциал) на первичной нуклеотидной
последовательности, характеризующая способность этой последовательности к образованию
плотной упаковки. Участки, где эта функция минимальна можно рассматривать как
мишени для воздействия регуляторных факторов.
Хранение информации о ГС и ее визуализация
Информация о процессах в генной сети можно хранить в виде базы данных. Одна из
таких баз данных, содержащая также графический интерфейс и некоторые средства
для моделирования динамики генной сети - GeneNet
[3; 14], разработанная в Новосибирске. При моделировании динамики можно указать
элемент ГС, параметры которого меняются и проследить на графике к каким изменениям
в поведении различных компонентов ГС это приведет. В настоящее время для моделирования
доступны две ГС: дифференцировки эритроцитов и регуляции холестерина.
Известны также другие базы данных, включающие данные о метаболических генных сетях.
Упомянем некоторые из них:
Хуже обстоит дело с приложениями, предназначенными для работы в off-line режиме.
Таких приложений автору обзора неизвестно.
Надо отметить, что визуализация ГС требует решения и некоторых математических
задач. Например, встают вопросы о рациональном размещении ее элементов на экране.
Такие средства предложены, например, в [15]. При этом используются наработки теории
графов.
Анализ ГС
Логический анализ ГС позволяет выявлять замкнутые регуляторные контуры, ключевые
элементы ГС, все связи заданного элемента до определенной глубины и т.д. Такие
средства обычно встроены в интерфейс программы работы с ГС, например, GeneNet.
Качественно проанализировать работу ГС можно выделив в ней положительные и отрицательные
ОС. Примеры такого анализа представлены в [1]. Там в частности отмечены некоторые
особенности, характерные для ГС определенных типов, и позволяющие классифицировать
ГС:
- ГС необратимых процессов, контролирующие рост и развитие организмов, дифференцировку
клеток, морфогенез тканей и органов содержат контуры положительной ОС, обеспечивающие
максимально эффективное отклонение контролируемого параметра от исходного значения.
В [1] анализируются два примера ГС этого типа: ГС дифференцировки эритроцитов
и ГС, регулирующая прорастание семян. Во втором случае быстрое и необратимое развитие
процесса обеспечивается не только наличие положительной ОС, но и кассетная активация
генов, т.е. запуск транскрипции нескольких генов одним фактором.
- ГС, обеспечивающие гомеостаз организма, напротив обычно содержат контуры отрицательной
ОС. В качестве примеров в [1] рассмотрены ГС регуляции уровня холестерина в клетке
и ГС азотфиксации у бобовых. В последнем случае речь идет о симбиотической ГС,
управляющей функцией генов двух организмов и контролирующей процесс своего формирования.
- ГС, обеспечивающие ответ организма на изменение внешних условий часто имеют
двухэтапную схему работы: сначала происходит быстрая активация за счет положительной
ОС, затем включается отрицательной ОС, которая подавляет ответ. Это сходно с формированием
импульса возбуждения в активной среде. В качестве примера рассмотрены ГС противовирусного
ответа и ГС теплового шока. В последнем случае, положительная ОС пока не обнаружена.
- ГС, обеспечивающие циклические процессы. Пример: клеточный цикл. [4].
Существование еще одного типа ГС, отвечающего за эпигенетические взаимодействия
позволяет предположить, например, работа [10]. Речь идет о воздействиях регуляторных
факторов на саму структуру генома, приводящих к целенаправленным (а не случайным)
мутациям, и отражающуюся в наследовании. Можно предположить, что воздействие здесь
должны носить пороговый характер c достаточно высоким порогом.
В [5-8] предложен обобщенный химико-кинетический метод моделирования генных сетей.
В рамках метода каждый процесс в генной сети описывается при помощи элементарного
блока. Блоки могут иметь различную математическую природу. Так в [8] рассмотрены
блоки, соответствующие ОДУ, арифметическим операциям, условному и стохастическому
автоматам. ГС конструируется из таких элементарных блоков, аналогично тому как
это делается в пакете simulink системы matlab. В итоге получается математическая
модель динамики ГС. В частности, часто элементарные блоки выбираются в виде ОДУ,
известных из химической кинетики.
Предпринимались попытки анализа, какие типы кинетики могут отвечать за отдельные
процессы в ГС. Так, в [37] показано, что кинетика Михаэлис-Ментен (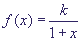 ) не пригодна
для моделирования биологического переключателя, т.к. для нее не удается получить
более одного равновесия в системе (в работе показано, что учет динамики РНК не
меняет ситуацию качественно) ) не пригодна
для моделирования биологического переключателя, т.к. для нее не удается получить
более одного равновесия в системе (в работе показано, что учет динамики РНК не
меняет ситуацию качественно)
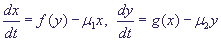
Наоборот, кинетики Хилла (Hill function 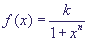 , n > 1), описывающая кооперативное связывание,
позволяет при правильно подобранных параметрах моделировать такой переключатель.
Под кооперативным связыванием понимается ситуация, когда для инициации трансляции
необходимо связывание нескольких операторных сайтов, причем связывание одного
из них влияет на связывание другого. Для случая, когда одна из функций описывается
кинетикой Хилла, а другая Михаэлис-Ментен, также позволяет конструировать переключатель. , n > 1), описывающая кооперативное связывание,
позволяет при правильно подобранных параметрах моделировать такой переключатель.
Под кооперативным связыванием понимается ситуация, когда для инициации трансляции
необходимо связывание нескольких операторных сайтов, причем связывание одного
из них влияет на связывание другого. Для случая, когда одна из функций описывается
кинетикой Хилла, а другая Михаэлис-Ментен, также позволяет конструировать переключатель.
Сложной задачей при построении ГС остается правильный выбор многочисленных параметров
модели. В некоторых случаях параметры ОДУ, описывающих ГС можно получить из данных
временного эксперимента [13].
Для некоторых задач используются модели ГС в виде уравнений в частных производных
типа реакция-диффузия. Например, при рассмотрении морфогенеза, как в [19].
Одной из задач анализа генной сети является выяснение качественных особенностей
поведения соответствующей ей динамической системы. В частности, число и характер
положений равновесия и предельных циклов.
В [9] показано, что в некоторых случаях характерные черты фазового портрета могут
быть обнаружены уже при изучении графа связей ГС. В частности там приведен эмпирический
(n,k)-критерий, позволяющий, при некоторых весьма ограничивающих предположениях,
сделать вывод о числе и устойчивости положений равновесия и предельных циклов.
Эта работа указывает направление работы: поиск менее ограничительных критериев
и их аналитическое обоснование.
Надо отметить, что при этом ГС описывается на языке так называемых генетических
элементов (ГЭ), т.е. блоков, содержащих ген, соответствующие мРНК и белок. Регулирующие
взаимодействия при этом действуют со стороны одного ГЭ на другой. В реальной ГС
такое описание также возможно, но на месте ГЭ может оказаться и отдельный белок
или низкомолекулярное соединение. Так на рисунке 2 показан в этих терминах фрагмент
ГС прорастания семени растения, представленный подробно в [1], причем элементы
gibberelins и ABA соответствуют низкомолекулярным соединениям, VP1 - белку, а
остальные - ГЭ. На рис. 3 аналогичным образом представлена ГС, отвечающая за развитие
лапки дрозофилы, рассмотренная в [19] и представленная там в виде таблицы связей.
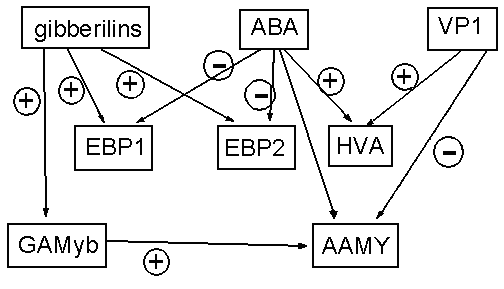
Рисунок 2. Фрагмент внутриклеточной ГС прорастания семени
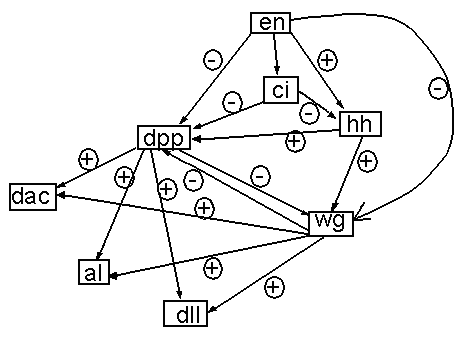
Рисунок 3. ГС роста лапки дрозофилы
При моделировании в [19] динамика ГС описывалась уравнениями
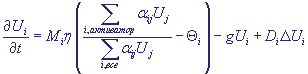
Здесь Ui - концентрация i -го протеина,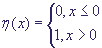 , остальные величины - константы ГС. Относительно
них в работе сказано, что они в настоящее время определяются "ручной оптимизацией",
а в будущем предполагается разработать "оптимизационный алгоритм для определения
идеального набора параметров для моделирования". , остальные величины - константы ГС. Относительно
них в работе сказано, что они в настоящее время определяются "ручной оптимизацией",
а в будущем предполагается разработать "оптимизационный алгоритм для определения
идеального набора параметров для моделирования".
Иногда в такие системы включаются и стохастические члены.
В [18] предлагается моделировать динамику ГС на языке алгебры логики, т.е. двоичных,
а не непрерывных сигналов. Тот же подход изложен в [22] и положен в основу моделирования
ГС в системе GeNet. В этом подходе состояние каждого гена в каждый момент времени
характеризуется 0, если ген выключен и 1, если включен. ГС в момент времени t характеризуется
вектором состояний всех ее генов ai(t), а переход от одного состояния к другому происходит
по формуле 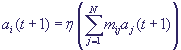 , где N - число генов в ГС, и постоянная матрица , где N - число генов в ГС, и постоянная матрица 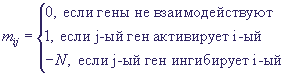
Главным преимуществом двоичных моделей ГС является их простота, что позволяет
прослеживать динамику ГС в течении достаточно длительного времени. Но, безусловно,
такая модель является довольно грубой.
Возможен и гибридный подход к моделированию динамики ГС. Он представлен, например,
в [12], а пример его применения к эукариотической ГС в [11]. Там предложено разделить
сеть на управляющую подсистему, моделирование которой проводится на языке дискретных
моделей и управляемую, которая моделируется обычными непрерывными ОДУ. В итоге
модель формулируется на языке кусочно-линейных систем ОДУ, которые решаются аналитически.
В [23] указаны основные направления, в которых ведутся работы по математическому
моделированию ГС. С одной стороны, это исследование абстрактных модельных ГС с
целью ответа на некоторые общие вопросы, такие как
- Выявление условий существования множества устойчивых равновесий и условий переключения
между ними. Такие системы описывают биологические переключатели режима работы
ГС. В [24] получены условия для существования таких множественных равновесий в
ГС из двух генов, а в [25] - оценка для числа устойчивых равновесий в зависимости
от числа регуляторных элементов в ДНК
- Изучение "степени устойчивости" положений равновесия и влияния на нее различных
факторов. Понятно, например, что наличие отрицательной ОС увеличивает, а положительной
- уменьшает устойчивость равновесия. Исследовалось также влияние количества молекул,
на которых основана работа переключателя на его устойчивость. До некоторого времени
считалось, что переключатели, основанные на малом числе молекул (десятки) не могут
быть слишком устойчивыми ввиду их подверженности случайным флуктуациям. Однако
недавняя работа [26] опровергла эту гипотезу.
- Условия возникновения осциляторных режимов функционирования ГС, в частности
необходимость присутствия положительных и отрицательных ОС и элементов временной
задержки.
С другой стороны ведутся работы по моделированию реальных ГС и сравнению результатов
с данными экспериментов. При этом возникают как трудности, связанные с моделированием
систем очень большой размерности, так и трудности проведения натурных экспериментов
с реальными ГС. Поэтому исследования концентрируются на относительно небольших
ГС (десятки ГЭ), допускающими прямое сравнение с экспериментальными данными. Примеры
таких моделей
- Бактериофаг λ способен работать в двух режимах: lysogenic,
когда его ДНК встраивается в ДНК хозяина и lytic, когда его ДНК экспрессирует
белки, необходимые для воспроизводства бактериофага. Переключение из первого
режима во второй происходит по активации бактериального протеина Recombinase
A. Согласия с натурными экспериментами удалось достичь только при введении
в систему стохастических элементов. В натурном эксперименте измерялось концентрация
лизогенов при различном количестве бактериофагов на клетку.
- Не вполне удачной была попытка моделирования фага T7. Причины неудач моделирования
обсуждаются в [27].
- Некоторые исследователи занимались динамикой производства триптофана в бактериальной
колонии. Результаты моделирования совпали с данными натурных экспериментов на
колонии мутантных E. Coli. Необходимые параметры ГС при этом брались из экспериментальных
измерений. Некоторые ссылки можно найти в [23]
- Следует упомянуть и различные работы про морфогенез дрозофилы. Некоторые ссылки
можно найти в [23]
В [23] указывается также на перспективу, которую открывает исследование искусственных
подсетей с заданными свойствами. Становится возможным выделение изолированных
подсетей из биосистемы и рассмотрение их динамики. Это позволяет перейти к рассмотрению
биосистем, как бы построенных из кубиков, взаимодействие которых определяет функционирование
организма. Такой подход не только позволит глубже понять как функционирует организм,
но и позволит создавать целенаправленные изменения в организмах для придания им
нужных свойств (генная инженерия). На пути построения искусственных ГС получены
некоторые успехи. Например, построены биологические переключатели, осцилляторы
(в том числе создание ГС с устойчивым к шуму периодом колебаний). В искусственных
ГС изучалось влияние регуляторных связей на устойчивость равновесия.
В [45] указывается, что понимание работы клетки, прежде всего, означает понимание
последнего перехода в иерархической схеме уровней организации клетки:
ДНК - РНК - белки - энзимы - сети химических реакций - физиология клетки
Указано, что для моделирования используются различные средства в зависимости
от типа процессов. Указаны типы моделей используемые в настоящее время для моделирования
различных процессов. (есть ссылки на более подробный анализ каждого типа моделей)
- ОДУ и булевские сети для моделирования генетических регуляторных связей
- Уравнения в частных производных и клеточные автоматы для моделирования пространственных
связей
- Интегро-дифференциальные и функциональные уравнения для учета временных задержек
и пространственных усреднений
- Стохастические уравнения при участии в процессе небольшого числа молекул.
Далее обсуждается модель деления клетки в дрожжах Schizosaccaromyces pombe.
Приведена структура ГС (16 ОДУ, около 30 параметров) и показан пример написания
двух кинетических уравнений на основе закона действующих масс. Впервые указано,
что в данном случае можно использовать ОДУ, поскольку пространственно-зависимые
и стохастические процессы (диффузия, транскрипция, трансляция, мембранный транспорт)
идут на временах порядка секунд, а описываемые процессы клеточного цикла на
временах порядка часов.
Коротко показаны результаты бифуркационного анализа данной системы. В частности
указывается, что переход между фазами клеточного цикла соответствует бифуркации
"седло-узел", а переход к митозу - "бифуркацией рождения цикла".
ЛИТЕРАТУРА
- Колчанов Н.А., Ананько Е.А., Колпаков Ф.А., Подколодная Ф.А., Игнатьева Е.В.,
Горячковская Т.Н., Степаненко И.Л. 2000. Генные сети. Мол. Биология, 34, с.
533 - 544.
- Ратнер В.А. Генетические управляющие системы. Новосибирск. Наука, 1966
- Н.А. Колчанов и др. Интегрированная компьютерная система по регуляции экспрессии
генов эукариот.Мол. Биология, 38 (2004), N1 с. 69 - 81.
- Кель О.В., Кель А.Э. Молекулярная биология. 1997, т. 31, с. 656 - 670.
- Bazhzn S.I., Likhoshvay V.A., Belova O.E. J. Theor. Biol., 1995. v. 175,
p.149 - 160.
- Belova O.E., Likhoshvay V.A., Bazhzn S.I., Kulichkov V.A. CABIOS, 1995, v.11,
p.213-218.
- Likhoshvay V.A., Matushkin Yu.G., Vatolin Yu.N., Bazhzn S.I.Computational
Technologies, 2000, v. 5, p.87 - 99.
- Лихошвай В.А., Матушкин Ю.Г., Ратушный А.В., Ананько Е.А., Игнатьева Е.В.,
Подколодная О.В. 2001. Обобщенный химико-кинетический метод моделирования генных
сетей. Мол. Биология, 35, с. 1072 - 1079.
- Лихошвай В.А., Матушкин Ю.Г., Фадеев С.И. 2001. О связи графа генной сети
с качественными режимами ее функционирования. Мол. Биология, 35, с. 1080 - 1087.
- Пузырев В.П. Вольности генома и медицинская патогенетика. Бюллетень Сибирской
Медицины, 2002, N2, с. 16 - 29. (medgenetics.pdf)
- Чуравев Р.Н., Галимзянов А.В. Моделирование реальных эукариотических управляющих
генных подсетей на основе метода обобщенных пороговых моделей. Мол. Биология,
35, с. 1088 - 1094.
- Tchuraev R .N.J.Theor Biol., 1991, v.151, p. 71 - 87.
- T. Chen, H.L. He, G.M. Church.. Modeling gene expression with differential
equations. Pacific symposium on biocomputing. 1999, p. 29 - 41.
- Ananko N.A., Podkolodny N.L., Stepanenko I.L., Ignatieva E.V., Podkolodnaja
O.A., Kolchanov N.A. 2002. GeneNet: a database on structure and functional organisation
of gene networks. Nucleic Acids Res. 30, p. 398 - 401.
- Самсонова М.Г., Серов В.Н., Трушкина А.С. Средства для визуализации структуры
генных сетей и их динамики. http://www.ibmh.msk.su/bioinformatics/a/a08-poster-rus.htm
- Levitsky V.G., Podkolodnaja O.A., Kolchanov N.A., Podkolodny N.L. 2001 Nucleosome
formation potential of eukaryotic DNA: tools for calculation and promoters analysis
Bioinformatics. 17, p.998 - 1010
- Turner D.H., Sugimoto N., Freier S.M. 1988. RNA structure prediction. Ann.
Rev. Biophys. Biophys Chem. 17, p.167 - 192.
- Kauffman S. J. Theor. Biol. 1969, v. 22, p. 437 - 467.
- K. Kyoda, H. Kitano. Simulation of genetic interaction for drosophila leg
formation. Pacific symposium on biocomputing. 1999, p. 77 - 90.
- Szallasi Z. Genetic network analysis in light of massively parallel biological
data acquisition. Pacific symposium on biocomputing. 1999, p. 5 - 17.
- Hertz J. Pacific symposium on biocomputing. 1998, http://www.nordita.dk/~hertz/projects.html.
- Samsonova M.G, Serov V.N. Network: an interactive interface to the toolls
for analysis of genetic network structure and dynamics. Pacific symposium on
biocomputing. 1999, p. 102 - 111.
- Hasty J., McMillen D., Isaacs F., Collins J.J. Computational studies of
gene regulatory networks in numero molecular biology. Nature reviews genetics
2, 2001 p.268 - 279.
- Cherry J.L., Adler F.R. How to make a biological switch. J. Theor. Biol.,
203 (2000), p.117 - 133.
- Wolf D.M. & Eeckman F.H. On the relationship between genomic regulatory
element organization and gene regulatory dynamics. J. Theor. Biol., 195 (1998),
p.167 - 186.
- Bialek W. Stability and noise in in biochemical switches. Adv. Neural Info
Process, 13, (MIT Press, Cambridge, Massachusetts).
- Endy D., You L. & Moulineux I.J.. Computational prediction and experimental
tests of fitness for bacteriophage T7 mutants with permuted genomes. Proc.
Natl. Acad. Sci. USA 97 (2000), p. 5375 - 5380.
- Thomas R. J. Theor. Biol. 1973, v. 42, p. 563 - 585.
- Savageau M. Biomed Biochem. Acta. 1985, v. 44, p.875 - 880.
- McAdams H., Arkin A. Proc. Natl.Acad. Sci. USA 1997, v. 94, p.814 - 819
- Kolpakov F.A., Ananko E.A.,Kolesov G.B., Kolchanov N.A. Bioinformatics,
1998, v. 14, p. 529 - 537.
- Thomas R., Thieffry D., Kauffman M. Dynamical behaviour of biological regulatory
networks - I. Biological role of feedback loops and practical use of the concept
of the concept of loop-characteristic state. Bull. Muth. Biol., 57 (1995), p.
247 - 276.
- Н. Грин, У. Стаут, Д.Тейлор. Биология в 3 томах. Т.2. М.Мир, 1990. Раздел
11.5, с. 54 - 60.
- К. Дедюв. Путешествие в мир живой клетки. М. Мир, 1987.
- М. Яффе, Г. Шатц. Будущее исследований митохондрий. В Перспективы биохимических
исследований. М. Мир, 1987. с. 137 - 143.
- Ю.С. Ченцов. Хондриом - совокупность митохондрий клетки. http://www.nature.ru/db/msg.html?mid=1157643&s
- Cherry J.L., Adler F.R. How to make a biological switch. J. Theor. Biol.,
203 (2000), p.117 - 133.
- Ю.С. Ченцов. Хондриом - совокупность митохондрий клетки. http://www.nature.ru/db/msg.html?mid=1157643&s
- Стрессовые белки - ключ к разгадке жизни. Интервью В.К. Войникова в "Восточно-Сибирской
Правде", март 2001.http://www.vsp.ru/23940/56-2-1.HTM
- М. Ермолаева, МГУ. Инструктивный апоптоз и рецепторы смерти. http://www.nature.ru/db/msg.html?mid=1160580&s=110300030
- Е. Плотников. Изучение цитотоксической активности донора оксида азота 3-нитро-4-фенилфуроксана
на экспериментальной модели клеток опухолевой линии hela. Дипломная работа.
http://greenvillage.narod.ru/diplom.html
- В.П. Скулачев. Старение организма - частный случай феноптоза. СОЖ, т. 7,
N10, 2001, с. 7 - 11.
- В.Д. Самуилов. Биохимия программируемой клеточной смерти (апоптоза) у животных.
СОЖ, т. 7, N10, 2001, с. 18 - 25.
- В.П. Скулачев. Явление запрограммированной смерти. Организм. СОЖ, т. 7,
N10, 2001, с. 2 - 6.
- J.J. Tyson, K.Chen, B. Novak. Network dynamics and cell physiology. Nature
reviews, 2 (2001), p.908 - 916. http://www.nature/reviews/molcellbio
- D.D. Newmeyer, S. Ferguson-Miller. Mitochondria: releasing power for life
and unleashing the machineries of death. Cell, v. 112 (2003) p. 481 - 490
- P.Kohl, D.Noble, R.L. Winslow, P.J.Hunter. Computational modeling of biological
systems: tools and visions. Phil.Trans.R. Soc. A 358, p.579 - 610
К оглавлению
|